افزایش پاسخ تومور به پرتودرمانی
محققان همچنین نشان دادهاند که روشهای تصویربرداری متابولیک غیرتهاجمی مبتنی بر طیفسنجی تشدید مغناطیسی (MRS) نشانگرهای زیستی متابولیک قابل اعتماد in vivo را ارائه میکنند که به طور بالقوه میتوانند برای یک رویکرد بالینی شخصی ترجمه شوند. در مورد لونیدامین (LND)، اندازهگیری لاکتات و بیوانرژتیکها با 1H- و 31P-MRS میتواند پنجره زمانی بهینه برای درمانها، دقیقاً چارچوب زمانی حداکثر اسیدیسازی ناشی از لونیدامین (LND) را شناسایی کند. رویکرد شخصیشده همچنین میتواند آن دسته از بیمارانی را که به درمان لونیدامین (LND) پاسخ میدهند شناسایی کند و در عین حال از افرادی که پاسخ نمیدهند صرفهجویی کند. این رویکرد، در صورت موفقیت آمیز بودن، پتانسیل افزایش رفاه مردان مبتلا به سرطان پروستات محدود به اندام را دارد.
سرطان پروستات یک بیماری چند کانونی است که بسته به تظاهرات آن با استفاده از جراحی، پرتودرمانی، محرومیت از آندروژن و شیمی درمانی قابل درمان است. پرتودرمانی با افزایش دوز استاندارد (RT) در محدوده 70 تا 80 گری (GY) یک گزینه درمانی استاندارد برای سرطان پروستات است. می توان از آن در مراحل مختلف بیماری استفاده کرد . متأسفانه، پرتودرمانی با افزایش دوز استاندارد برای سرطان پروستات با سمیت دستگاه گوارش و دستگاه تناسلی مرتبط است. محققان قبلا گزارش کردهاند که لونیدامین تعدیلکننده متابولیک (LND) از طریق اسیدی شدن تومور و انرژیزدایی (de-energization) در نئوپلاسمهای مختلف، حساسیت سرطان ایجاد میکند. ما فرض کردیم که لونیدامین (LND) میتواند با ایجاد همان اثر در سرطان پروستات، دوزهای کمتر پرتودرمانی با افزایش دوز استاندارد (RT) را مجاز کند، بنابراین عوارض جانبی مضر مرتبط با پرتودرمانی با افزایش دوز استاندارد (RT) را کاهش میدهد. با استفاده از آنالایزرهای Seahorse XFe96 و YSI 2300 Stat Plus، اسیدیسازی درون سلولی ناشی از لونیدامین (LND) و انرژیزدایی سلولهای سرطان پروستات انسانی جدا شده را با استفاده از رده سلولی PC3 تأیید کردیم. این نتایج توسط طیفسنجی تشدید مغناطیسی 31P غیرتهاجمی (MRS)، با مطالعه پیوندهای سرطان پروستات PC3 تحت درمان با لونیدامین (LND) (100 میلیگرم بر کیلوگرم، داخل صفاقی) اثبات شد. علاوه بر این، محققان دریافتند که لونیدامین (LND) به طور قابل توجهی سطوح لاکتات تومور را در زنوگرافت با استفاده از طیفسنجی تشدید مغناطیسی 1H MRS غیر تهاجمی افزایش داد. متعاقبا، لونیدامین (LND) با پرتودرمانی در آزمایش تاخیر رشد ترکیب شد، جایی که محققان دریافتند که 150 میکرومولار لونیدامین (LND) و به دنبال آن 4 گری پرتودرمانی تاخیر رشد قابل توجهی در پیوندهای سرطان پروستات PC3 در مقایسه با کنترل، لونیدامین (LND) یا پرتودرمانی به تنهایی ایجاد کرد.
نتیجه گرفته شد که تعدیلکننده متابولیک پرتودرمانی مدلهای آزمایشی سرطان پروستات را حساس میکند و امکان استفاده از دوزهای کمتر پرتو و کاهش عوارض جانبی بالقوه پرتودرمانی را فراهم میکند. این نتایج ترجمه بالینی پرتودرمانی را به عنوان یک حساس کننده رادیویی در بیماران مبتلا به سرطان پروستات پیشنهاد می کند.
سرطان پروستات دومین سرطان شایع در مردان و دومین عامل مرگ و میر ناشی از سرطان مردان است. بیش از 10 میلیون نفر در سراسر جهان با سرطان پروستات زندگی می کنند که هر ساله بیش از 1.4 میلیون مورد جدید تشخیص داده می شود و 375304 مورد مرگ ناشی از این بیماری گزارش شده است. در ایالات متحده در سال 2023، 288300 مورد سرطان پروستات گزارش شده است که با برآورد 34700 مرگ و میر، پیش بینی می شود این تعداد در آینده افزایش یابد. درمان سرطان پروستات به پیش آگهی و همچنین ترجیحات بیمار، توصیه پزشک، قابلیت عمل و بیماری همراه بستگی دارد. سرطان های موضعی پروستات پرخطر با پرتودرمانی فرسایشی (RT) یا پروستاتکتومی رادیکال با هدف درمانی درمان می شوند. مردان مبتلا به بیماری عودکننده موضعی یا سیستمیک با درمان محرومیت از آندروژن (ADT) به تنهایی یا همراه با پرتودرمانی یا شیمی درمانی درمان می شوند. اگرچه پاسخهای اولیه به این درمانها مطلوب است، 10 تا 20 درصد موارد به سرطان پروستات مقاوم به اخته متاستاتیک (mCRPC) پیشرفت میکنند که نسبت به ADT مقاوم است و بقای ضعیفی دارد. در این مرحله پیشرفته، بیماری غیر قابل درمان می شود و شیمی درمانی به استاندارد مراقبت برای کاهش سرعت پیشرفت آن تبدیل می شود.
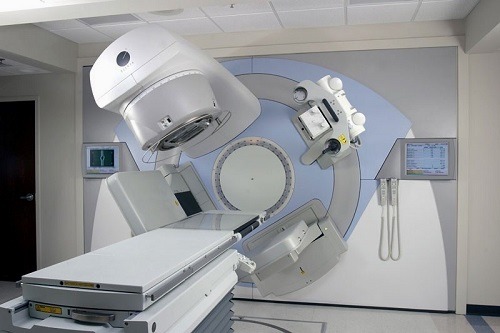
پرتودرمانی خارجی (EBRT) و براکی تراپی (BT) رایج ترین تکنیک های رادیو درمانی مورد استفاده در درمان سرطان پروستات هستند. پرتودرمانی خارجی (EBRT) پرتوهای یونیزان تولید شده توسط یک منبع تشعشع خارجی را در دوزهای موثر 50 تا 80 گری (GY) ارائه می دهد که بقای کلی را برای اکثر بیماران بهبود می بخشد. دوز پرتو درمانی ارائه شده در درمان پرتودرمانی خارجی (EBRT) در فرآیندی به نام شکنش معمولی به بخش هایی تقسیم می شود تا سمیت در بافت های طبیعی مرتبط با یک دوز بزرگ پرتو را کاهش دهد. درمان طی 8 تا 9 هفته انجام می شود و در 39 تا 45 کسر 1.8 GY تا 2 GY در هر کسری ارائه می شود. EBRT Hypo-fractionated از کسرهای با دوز بالاتر (19-28) کمتر از 2.5 GY تا 3.4 GY در هر کسری برای کنترل سرطان مشابه اما بالقوه بهبود یافته در مقایسه با استاندارد استفاده می کند. براکی تراپی (BT) شکلی از درمان است که در آن تابش به صورت داخلی از طریق دانهها یا کپسولهای رادیواکتیو کاشتهشده بهوسیله جراحی ارسال میشود و امکان تحویل دوز پرتوی قابل توجهتری را نسبت به سایر درمانهای رادیوتراپی(RT) فراهم میکند. در دوز کم براکی تراپی (BT) ، دانه های رادیواکتیو به طور دائم در پروستات کاشته می شوند، دوز متوسط 0.1 GY / ساعت برای چندین ماه، با دوز موثر کلی 120-160 GY بسته به نوع دانه استفاده شده و وضعیت خاص بیمار این اقدامات انجام می شود و وضعیت تومور در براکی تراپی (BT) با دوز بالا، کاتترهای موقت در پروستات وارد میشوند، جایی که تشعشع در دوزهای بیشتر 27 تا 35 GY در چندین بخش ارسال میشود. ترکیبی از پرتودرمانی خارجی (EBRT) و براکی تراپی (BT) با میزان دوز پایین نیز می تواند برای بیماران پرخطر در شرایطی که سرطان از پروستات به غدد لنفاوی لگنی اطراف پیشرفت کرده است استفاده شود.
کاربردهای جدید این تکنیکهای رادیودرمانی تثبیتشده و روشهای درمانی جدید به دنبال کاهش خطر اثرات سمی پرتو بر بافت سالم اطراف تومور هدف است، اما سمیت مرتبط با درمان هنوز رایج است. پرتودرمانی باعث اختلال در عملکرد ادرار می شود که منجر به علائم تحریک کننده و انسدادی مانند تکرر ادرار، فوریت، سوزش ادرار، انسداد مجرای ادرار، هماچوری و انقباض مثانه می شود. عملکرد جنسی نیز کاهش می یابد زیرا پرتودرمانی باعث کاهش قدرت از طریق آسیب مستقیم به اعصاب و نارسایی شریانی/وریدی می شود. اختلال عملکرد دستگاه گوارش نیز با فوریت رکتوم، خونریزی مقعدی، گرفتگی عضلات، اسهال، پروکتیت و بی اختیاری رخ می دهد. به ندرت، پرتودرمانی خارجی (EBRT)می تواند سرطان دوم را در بافت های تحت تابش ایجاد کند. بنابراین، خطر ابتلا به سرطان مثانه یا رکتوم در هنگام درمان مردان جوان مبتلا به سرطان پروستات مورد توجه قرار می گیرد.
بر اساس کار ما با سایر مدلهای سرطان (مانند ملانوما، سرطان سینه)، هدف محققان تعیین این بود که آیا لونیدامین تعدیلکننده متابولیک (LND) اثر مشابهی در سرطان پروستات دارد و تأثیر پرتودرمانی را در سرطان کم خطر پروستات تقویت میکند یا خیر. اگر لونیدامین (LND) بتواند حساسیت رادیویی را فراهم کند، میتواند دوز تابش را کاهش دهد و عوارض جانبی مضر مرتبط با رادیوتراپی(RT) را کاهش دهد و در عین حال به طور مؤثر بیماریهای محدود به اندام را درمان کند. اثر لونیدامین (LND) بر اساس برنامهریزی مجدد متابولیک سلولهای سرطانی است که تمایل به افزایش جذب گلوکز و تولید لاکتات با تغییر متابولیسم آنها برای تنظیم مجدد گلیکولیز دارد. این خاصیت متابولیک سرطان را می توان با استفاده از مدولاسیون متابولیک لونیدامین (LND) مورد بهره برداری قرار داد، که باعث اسیدی شدن درون سلولی انتخابی سرطان با به دام انداختن اسید لاکتیک در داخل سلول از طریق مهار ناقل های مونوکربوکسیلات (MCT1 و MCT4) و القای مرگ سلولی می شود. علاوه بر این، لونیدامین (LND) با مهار حامل پیروات میتوکندری (MPC) و کمپلکس II زنجیره انتقال الکترون به سلول های سرطانی آسیب می رساند. لونیدامین (LND) همچنین سطوح عامل کاهنده متابولیک گلوتاتیون (GSH) را کاهش میدهد و با افزایش غلظت اکسیژن تومور، تشکیل گونههای اکسیژن فعال (ROS) را القا میکند و سلولها را نسبت به درمان، از جمله رادیوتراپی(RT) آسیبپذیرتر میکند. در نتیجه اسیدی شدن داخل سلولی لونیدامین (LND) در سلول های سرطانی ایجاد می کند، همچنین می تواند هگزوکیناز-2 و دیگر آنزیم های گلیکولیتیک و مراحل مسیر پنتوز فسفات را مهار کند. علاوه بر این، لونیدامین (LND) در آزمایشهای بالینی سرطانها بیخطر ثابت شده است، زیرا فاقد سمیت برای مغز استخوان و سایر بافتها است. با این حال، عاری از عوارض جانبی مانند میالژی و درد بیضه نیست.


ارسال به دوستان